张志超教授的化学生物学课题组在白血病新靶标发现—药物设计—分子标志物确认一体化研究方面取得系列进展,研究工作自2020年至今陆续发表在自然指数期刊J Biol Chem., 2020, 295, 12900; 医学大类Q1杂志Eur J Med Chem., 2021, 220, 113452; Nature旗下杂志Leukemia., 2021, doi:10.1038/s41375-021-01283-5。Leukemia是美国白血病学会会刊,在血液病学期刊中排名第3,在肿瘤学期刊中排名第9。
慢性粒细胞白血病(CML)是一种以BCR-ABL 融合基因形成为特征的骨髓增殖性恶性肿瘤。虽然BCR-ABL的小分子酪氨酸激酶抑制剂(TKI)—伊马替尼(格列卫, IM)革命性地提高了CML患者的生存期,但是约20%-30%的患者对IM产生耐药,其中部分CML患者能够通过不依赖BCR-ABL调控的耐药机制产生逃逸,导致2-3代TKIs治疗也无效,成为目前治疗CML的最大难题。非BCR-ABL依赖性TKIs耐药的分子机制与BCR-ABL的非激酶机制、肿瘤效应因子的旁路激活等多种未知的功能和机制相关。发现新的肿瘤靶标是CML等BCR-ABL阳性肿瘤的基础研究和靶向药物研发的核心和关键。
张志超教授课题组一直研发Bcl-2蛋白的靶向抗癌药物,在2020年最新发现Bcl-2家族的一个主要成员Bim还能作为Hsp70蛋白的辅助伴侣蛋白,结合于Hsp70蛋白的一个类BH3沟槽,该成果已经发表于自然指数 (Nature Index)收录的82种全球顶级期刊之一(J Bio Chem., 2020, 295, 12900)。以此为基础,该文章的通讯作者宋婷副教授提出假说,在目前已有的靶向BH3沟槽的Bcl-2抑制剂中,可能存在兼容、或者特异性结合Hsp70的BH3沟槽的小分子抗癌候选药物。因此,与课题组具有丰富的有机合成、药物化学理论和实践经验的王紫千博士后密切合作,综合运用化学和生物学多学科技术手段,迅速从该团队已经创制的Bcl-2抑制剂分子库中筛选获得了首个特异性的Hsp70/Bim小分子抑制剂S1g-2。相关成果由王紫千博士后发表于医学大类Q1杂志Eur J Med Chem., 2021, 220, 113452.
接下来,该团队进一步针对TKIs耐药的白血病开展转化医学和创新药物研究,利用S1g-2系列衍生物成功揭示了Hsp70/Bim调控CML细胞逃避1-3代TKIs诱导凋亡的分子机制,明确Hsp70/Bim是克服非BCR-ABL依赖性TKIs耐药的肿瘤靶标,在细胞水平和动物体内证明S1g-2具有高效低毒的抗CML活性,和逆转非BCR-ABL依赖性TKIs耐药的作用,为CML治疗提供了全新机制、全新结构的抗癌先导化合物。相关成果由宋婷副教授发表于Nature旗下杂志Leukemia., 2021, doi:10.1038/s41375-021-01283-5。
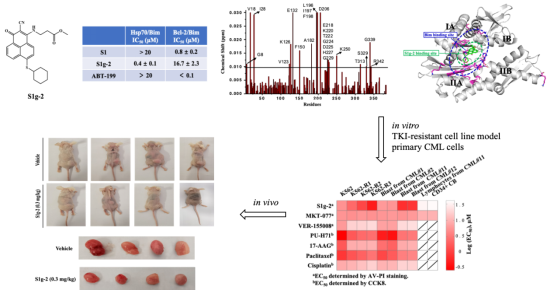
图1. 首个靶向Hsp70/Bim的小分子抑制剂S1g-2在TKIs耐药的CML细胞和小鼠移植瘤模型中表现出高效低毒的抗肿瘤活性
在这项研究中,团队通过基于表型的筛选,意外发现在TKIs耐药的CML细胞系和TKIs耐药病人来源的CML原代细胞中,随着TKIs耐药指数的增高,S1g-2的诱导凋亡活性反倒越来越强,完全相反于已知的Hsp70抑制剂MKT-077和VER-155008。团队进一步设计合成了生物素标记的S1g-2分子探针,结合IP-MS蛋白质互作组学技术、生物信息学方法,全面系统地揭示了Hsp70/Bim发挥抗凋亡功能的信号转导通路:eIF2信号通路, eIF4E和 p70S6K 通路, 以及mTOR信号通路。在非BCR-ABL依赖性TKIs耐药的CML中,Hsp70通过招募Bim作为辅助伴侣蛋白,加强了对通路中的关键节点蛋白AKT,Raf-1和eIF4E等底物蛋白的结合和稳定,导致这些下游激酶不再依赖BCR-ABL被激活,CML细胞对TKIs的凋亡逃逸能力越来越强。这项研究揭示了新的BCR-ABL阳性肿瘤旁路激活导致的TKI耐药分子机制。该研究得到了国家自然科学基金及大工辽肿医工合作项目的资助。
原文链接: ,